top of page

Conductividad eléctrica
Consiste en un movimiento o desplazamiento de carga eléctrica a través de ellas. Este movimiento de carga puede realizarse de dos maneras:

Mediante un flujo de electrones, como sucede en los metales, llamados conductores de primera especie

Mediante el movimiento de iones positivos y negativos a través de una disolución o de un compuesto iónico fundido. Esta se denomina conductividad iónica o electrolítica.
Definiciones

Electrólisis es el proceso en el que el paso de la corriente eléctrica por una disolución o por un electrolito fundido produce una reacción de oxidación-reducción no espontánea

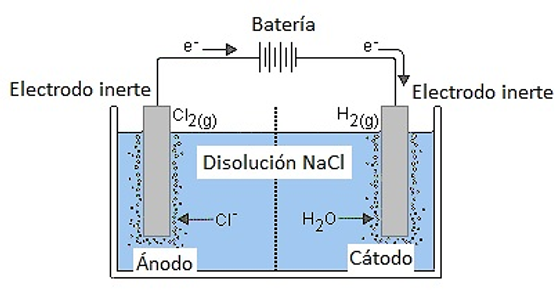
La celda electrolítica es el recipiente donde se realiza el proceso. Contiene la disolución o el electrolito fundido en el que se sumergen los electrodos conectados a una fuente de corriente continua de la que la cuba recibe los electrones.


El ánodo es el electrodo donde se produce la oxidación, se conecta al polo positivo de la fuente de corriente continua.

Los electrodos son las superficies sobre las que se producen las semirreacciones de oxidación-reducción. Son inertes a los reactivos que contiene la cuba electrolítica.

El cátodo, electrodo en el que tiene lugar la reducción, se conecta al polo negativo.
Tipos de electrolisis
A continuación vamos a estudiar algunos ejemplos de electrólisis de distintas sustancias, las reacciones que tienen lugar y el esquema de su realización.

bottom of page